A redução da massa e da função muscular pode aumentar substancialmente o risco de quedas, fraturas, incapacidade física e mortalidade (Beaudart et al, 2017; Cruz-Jentoft et al, 2019). Essa condição frequentemente se sobrepõe à fragilidade física, ou seja, redução da capacidade de manter o desempenho físico e a sensação de bem-estar ao longo do tempo (Cruz-Jentoft et al, 2017). De fato, pacientes “frágeis” sofrem declínio na força muscular, velocidade da marcha e tolerância ao esforço (Buch et al, 2016), levando à perda de independência das atividades diárias e aumento das internações hospitalares (Vermeiren et al, 2016). Embora a perda de massa muscular e a fragilidade física sejam duas condições distintas com diferentes critérios diagnósticos, elas compartilham um fundo fisiopatológico comum e, na perspectiva do paciente, apresentam sintomas negativos semelhantes (Cruz-Jentoft et al, 2017; Landi et al, 2015). Portanto, cada vez mais são vistos como dois lados da mesma moeda.
Nesse cenário, as evidências científicas estão concentrando cada vez mais seus interesses no possível envolvimento da microbiota intestinal na fisiopatologia muscular. Alterações na composição da microbiota intestinal podem, de fato, promover inflamação crônica e resistência anabólica, condicionando a redução do tamanho e função muscular e resultados clínicos adversos (Grosicki et al, 2018; Ticinesi et al, 2017). Nesse possível eixo músculo- intestino, a disfunção da função da barreira mucosa intestinal pode desempenhar um papel central (Sovran et al, 2019), favorecendo a entrada de produtos microbianos ou micróbios na circulação sistêmica (Bufford et al, 2018) e contribuindo para ativar a resposta inflamatória e induzir desregulação do sistema imunológico (Ferrucci & Fabbri, 2018; Ticinesi et al, 2019).
Estudos realizados em modelo animal mostraram que a microbiota intestinal influencia consistentemente o equilíbrio metabólico do hospedeiro. Camundongos livres de germes exibem um fenótipo magro, mesmo quando alimentados com uma dieta rica em gordura (B?ckhed et al, 2007). O transplante de microbiota fecal de humanos desnutridos para camundongos livres de germes também resultou em déficits de crescimento, mesmo na presença de uma dieta equilibrada (Blanton et al, 2016). Ainda, o transplante da microbiota intestinal de suínos para ratos magros e livres de germes resultou em mudanças significativas na estrutura das fibras musculares, semelhante à típica dos suínos (Yan et al, 2016). Assim, a microbiota pode atuar como um transdutor de sinais de nutrientes para o hospedeiro e, em situações fisiológicas, a própria dieta contribui para moldar a composição e funcionalidade da microbiota (Shanahan et al, 2017).
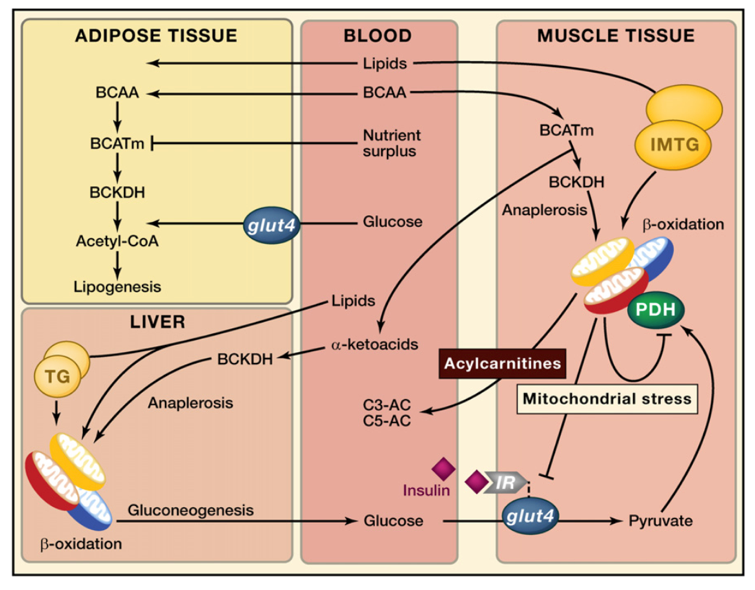
Sabe-se que a ingestão de proteínas tem um efeito anabólico no músculo esquelético, favorecendo o incremento de massa muscular em sinergia com o exercício de força (Ni et al, 2018; Liao et al, 2019). Esse efeito pode ser mediado pela microbiota intestinal. Em modelo animal, já foi observado que a taxa de crescimento muscular é profundamente influenciada por metabólitos específicos da microbiota intestinal, sugerindo um papel fundamental da microbiota na absorção de aminoácidos e na promoção do anabolismo muscular (Stanley et al, 2012). Em um recente estudo randomizado realizado em 38 seres humanos com excesso de peso, recebendo um suplemento isocalórico por três semanas contendo caseína e proteína de soja ou maltodextrina como controle. A suplementação de proteína resultou em mudança significativa no metabolismo bacteriano de modo a favorecer a fermentação de aminoácidos (Beaumont et al, 2017). Isso significa que a microbiota intestinal pode contribuir com o anabolismo proteico no hospedeiro, aumentando a biodisponibilidade de aminoácidos, estimulando a secreção de insulina e a capacidade de resposta no músculo esquelético. De fato, estudos em animais demonstraram que um aumento na produção de aminoácidos de cadeia ramificada (BCAAs) pela microbiota, típico de uma proporção normalizada de Firmicutes/Bacteroidetes, está associado à melhora da sensibilidade à insulina e à síntese proteica (Lynch & Adams, 2014). No entanto, esses mecanismos foram questionados por estudos realizados em seres humanos, onde níveis séricos elevados de BCAA geralmente estão associados com resistência à insulina (Lynch & Adams, 2014).
Poucos estudos focados na microbiota intestinal humana consideraram a possível correlação com a força de preensão manual. Em um estudo observacional, Bjørkhaugh et al. (2019) compararam a composição da microbiota fecal de um grupo de 24 indivíduos com consumo excessivo de álcool e 18 controles, considerando o estado nutricional e a força de preensão manual. Os autores observaram que os consumidores de álcool tinham menor força de preensão manual, maior abundância de Proteobacteria, Sutterella, Clostridium e Holdemania e menor abundância de Faecalibacterium. Essas alterações na composição da microbiota fecal também foram acompanhadas por níveis fecais reduzidos de ácidos graxos de cadeia curta, indicando um microambiente pró-inflamatório. Embora as alterações da microbiota intestinal tenham sido provavelmente determinadas pelo consumo de álcool e pelo estado nutricional abaixo do ideal, esses resultados sugerem que a microbiota pode ter alguma influência na força muscular.
Em conclusão, a literatura sugere que a microbiota intestinal está associada ao desempenho físico e que a associação pode ser recíproca. As perdas de força e de massa muscular estão associadas a diferentes graus de disbiose. Esses conceitos apoiam a existência de um eixo intestino-músculo e, nesta perspectiva, a microbiota intestinal pode estar ativamente envolvida na fisiopatologia do músculo esquelético e pode representar um alvo terapêutico nutricional.
Referências Bibliográficas:
B?ckhed F, Manchester JK, Semenkovich CF, Gordon JI. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proc. Natl. Acad. Sci. USA. 2007; 104: 979–984. / Beaudart C, Zaaria M, Pasleau F, Reginster JY, Bruyère O. Health outcomes of sarcopenia: A systematic review and meta-analysis. PLoS ONE. 2017; 12: e0169548. / Beaumont M, Portune KJ, Steuer N, Lan A, Cerrudo V, Audebert M, Dumont F, Mancano G, Khodorova N, Andriamihaja M, et al. Quantity and source of dietary protein influence metabolite production by gut microbiota and rectal mucosa gene expression: Q randomized, parallel, double-blind trial in overweight humans. Am. J. Clin. Nutr. 2017; 106: 1005–1019. / Blanton LV, Charbonneau MR, Salih T, Barratt MJ, Venkatesh S, Ilkayeva O, Subramanian S, Manary MJ, Trehan I, Jorgensen JM, et al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children. Science 2016;351:aad3311. / Buch A, Carmeli E, Boker LK, Marcus Y, Shefer G, Kis O, Berner Y, Stern N. Muscle function and fat content in relation to sarcopenia, obesity and frailty of old age—An overview. Exp. Gerontol. 2016; 76: 25–32. / Buford TW, Carter CS, VanDerPol WJ, Chen D, Lefkowitz EJ, Eipers P, Morrow CD, Bamman MM. Composition and richness of the serum microbiome differ by age and link to systemic inflammation. Geroscience. 2018; 40: 257–268. / Bjørkhaug S.T., Aanes H., Neupane S.P., Bramness J.G., Malvik S., Henriksen C., Skar V., Medhus A.W., Valeur J. Characterization of gut microbiota composition and function in patients with chronic alcohol overconsumption. Gut Microbes 2019; 10: 663-675. / Cruz-Jentoft AJ, Kiesswetter E, Drey M, Sieber CC. Nutrition, frailty, and sarcopenia. Aging Clin. Exp. Res. 2017 ;29: 43–48. / Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, et al. European Working Group on Sarcopenia in Older People 2 (EWGSOP2); Extended Group for EWGSOP2. Sarcopenia: Revised European consensus on definition and diagnosis. Age Ageing 2019; 48: 16–31. / Ferrucci L, Fabbri E. Inflammageing: Chronic inflammation in ageing, cardiovascular disease, and frailty. Nat. Rev. Cardiol. 2018; 15: 505–522. / Grosicki GJ, Fielding RA, Lustgarten MS. Gut microbiota contribute to age-related changes in skeletal muscle size, composition, and function: Biological basis for a gut-muscle axis. Calcif. Tissue Int. 2018; 102: 433–442. / Landi F, Calvani R, Cesari M, Tosato M, Martone AM, Bernabei R, Onder G, Marzetti E. Sarcopenia as the biological substrate of physical frailty. Clin. Geriatr. Med. 2015; 31: 367–374. / Liao Y, Peng Z, Chen L, Zhang Y, Cheng Q, Nüssler AK, Bao W, Liu L, Yang W. Prospective views for whey protein and/or resistance training against age-related sarcopenia. Aging Dis. 2019; 10: 158–174. / Lynch CJ, Adams SH. Branched-chain amino acids in metabolic signaling and insulin resistance. Nat. Rev. Endocrinol. 2014; 10: 723–736. / Ni Lochlainn M, Bowyer RCE, Steves CJ. Dietary protein and muscle in aging people: The potential role of gut microbiome. Nutrients. 2018; 10: 929. / Shanahan F, van Sinderen D, O’Toole PW, Stanton C. Feeding the microbiota: Transducer of nutrient signals for the host. Gut. 2017; 66: 1709–1717. / Stanley D, Denman SE, Hughes RJ, Geier MS, Crowley TM, Chen H, Haring VR, Moore RJ. Intestinal microbiota associated with differential feed conversion efficiency in chickens. Appl. Microbiol. Biotechnol. 2012; 96: 1361–1369. / Sovran B, Hugenholtz F, Elderman M, Van Beek AA, Gravesen K, Huijskes M, Boekschoten MV, Savelkoul HFJ, De Vos P, Dekker P, et al. Age-associated impairment of the mucus barrier function is associated with profound changes in microbiota and immunity. Sci. Rep. 2019; 9: 1437.
Fonte: Vitaforscience