
Nas últimas décadas, a obesidade atingiu proporções epidêmicas em muitos países ao redor do mundo. Hoje, sabemos que a pandemia da obesidade está fortemente ligada a várias doenças crônicas como diabetes, hipertensão e doenças cardiovasculares (Hedley et al., 2004; Sowers, 2003). Nos Estados Unidos, mais de 65% dos adultos são caracterizados com sobrepeso ou obesidade (Flegal et al., 2002). Um fator em comum é que esta gama de doenças pode ser impulsionada principalmente pelo aumento do consumo de gordura na dieta que, por sua vez, pode levar ao estresse mitocondrial e endoplasmático, inflamação local e sistêmica e geração de espécies reativas de oxigênio.
A relação entre o metabolismo de glicose e o lipídico tem sido reconhecida há décadas, sendo os estudos dos grupos de Phillip Randle e J. Denis McGarry pioneiros no assunto (Randle, 1998; McGarry, 2002). Randle mostrou que o aumento da lipólise e o consequente aumento dos ácidos graxos livres na circulação no estado de jejum contribuem para o aumento na oxidação lipídica para o fornecimento de energia sendo que, nessas circunstâncias, a oxidação da glicose é reduzida. Por outro lado, McGarry demonstrou que o aumento da disponibilidade de glicose e insulina no estado alimentado (pós-prandial) leva à produção de malonil-CoA, um potente inibidor da oxidação de ácidos graxos. Como consenso, sabemos que o consumo calórico excessivo resulta na perturbação desses mecanismos de controle recíproco, levando a uma condição denominada “inflexibilidade metabólica” (Kelley & Mandarino, 2000).
Alguns dados recentes descreveram a associação entre o consumo de aminoácidos de cadeia ramificada (popularmente conhecidos como BCAAs) com a incidência de distúrbios metabólicos, particularmente, com a resistência à insulina. Estudos recentes demonstraram que alguns metabólitos derivados dos BCAAs podem ser preditivos de progressão do quadro. Por exemplo, recentemente Svetkey et al. (2008) estudaram 500 indivíduos obesos dos quais colhidas amostras de sangue no início e ao longo de 6 meses de intervenção nutricional para perda de peso. O perfil metabólico das amostras de plasma coletadas revelou forte relação entre a concentração de BCAAs e a resistência/sensibilidade à insulina. Wang et al. (2011) avaliaram amostras de plasma de 189 indivíduos que desenvolveram diabetes tipo 2 em até 12 anos de acompanhamento e compararam amostras de 189 indivíduos controles que não desenvolveram diabetes. Os cinco metabolitos plasmáticos com a associação mais forte com o diabetes foram: leucina, isoleucina, valina, fenilalanina e tirosina. Ainda, foi confirmada a capacidade desses metabólitos em prever o diabetes.
Dois artigos publicados em periódicos da revista Cell, pelo mesmo grupo de pesquisa chamaram a atenção para a relação entre BCAAs e resistência a insulina. O primeiro, em um corte transversal, demonstrou que indivíduos obesos apresentam menor atividade da enzima responsável por transaminar os BCAAs no tecido adiposo. Como consequência, foi observada uma maior concentração no plasma destes aminoácidos em comparação a indivíduos eutróficos. Como hipótese, esse excedente plasmático, por sua vez, geraria um estresse mitocondrial muscular e o consequente excesso de acil-carnitinas. Estes são metabólitos que são constantemente produzidos como resultado da oxidação lipídica. Porém, quando produzidos em excesso, podem contribuir para o quadro de resistência à insulina (Newgard et al, 2009). Em outras palavras, o excesso plasmático de BCAAs causado por uma falha no metabolismo do tecido adiposo geraria excesso destes metabólitos por estresse mitocondrial. Nessas circunstâncias, portanto, não seria recomendado o consumo de BCAAs.
O segundo artigo, uma revisão da literatura, fecha a tríade entre resistência à insulina, BCAAs e o consumo lipídico. O excesso de ácidos graxos plasmáticos em decorrência de manobras nutricionais como a dieta hiperlipídica, por exemplo, poderia gerar estresse mitocondrial em decorrência da lipólise. Nessa condição, o consumo de BCAAs também seria interpretado como um agravante na formação de acil-carnitinas e consequente resistência à insulina (Newgard, 2012). A figura abaixo, resume a relação entre os 3 fatores:
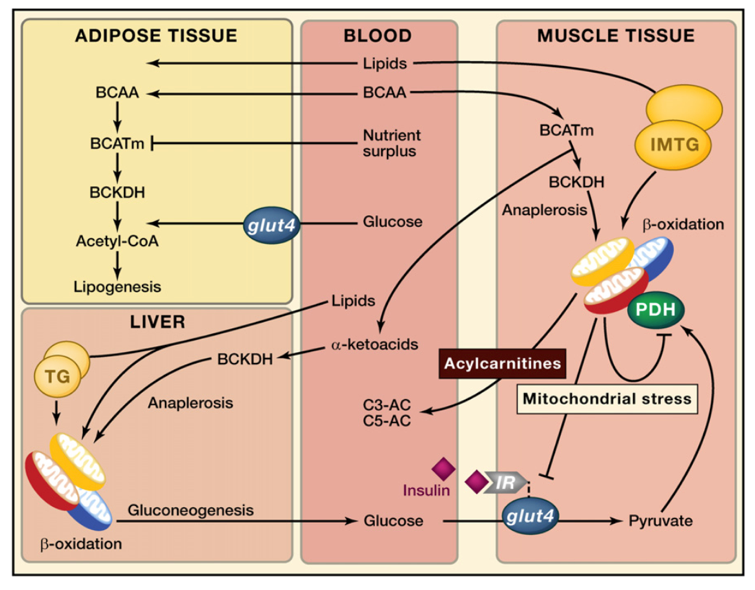
Relação entre o quadro de resistência à insulina e a concentração plasmática de ácidos graxos e aminoácidos de cadeia ramificada. Extraído de Newgard et al. (2012)
Contudo, devidos a estas hipóteses que questionavam a segurança da suplementação, até o presente momento, nenhum estudo havia proposto o consumo de BCAAs de modo longitudinal em quadro de resistência a insulina. Recentemente, o American Journal of Clinical Nutrition (uma das revistas mais conceituadas da área de nutrição) publicou um estudo que nos dá outra perspectiva. Woo et al. (2019) suplementaram indivíduos obesos e portadores de resistência à insulina (pré-diabéticos) com 20g de BCAAs durante 6 meses. Os autores observaram que o grupo suplementado com BCAA tendeu a melhorar a sensibilidade a insulina, medida pelo OGTT, sem afetar a concentração plasmática de insulina. Adicionalmente o grupo que consumiu menor concentração de BCAAs tendeu a apresentar maiores índices de resistência a insulina, demonstrando que, embora os BCAAs não apresentem efeitos terapêuticos ergogênicos, a falta deles pode não ser interessantes.
Este é o típico artigo que traz uma possível quebra de paradigma. “Possível” pois não podemos afirmar categoricamente com base em 1 publicação (embora seja de alto respaldo), entretanto, esta evidência abre novos horizontes e perspectivas não só sobre a utilização de BCAAs mas, principalmente, pela forma como estávamos correlacionando o consumo destes aminoácidos com o quadro de resistência à insulina. Como toda conclusão, novas evidências são necessárias, porém, evidências que vem para desafiar os conceitos estabelecidos até então.
Referências Bibliográficas:
Flegal KM, Carroll MD, Ogden CL, Johnson CL. Prevalence and trends in obesity among US adults, 1999-2000. JAMA (2002); 288: 1723–1727. /Hedley, A.A., Ogden, C.L., Johnson, C.L., Carroll, M.D., Curtin, L.R., and Flegal, K.M. Prevalence of overweight and obesity among US children, adolescents, and adults, 1999-2002. JAMA (2004); 291:2847–2850. / Kelley DE, Mandarino LJ. Fuel selection in human skeletal muscle in insulin resistance: a reexamination. Diabetes. 2000 May;49(5):677-83. / McGarry JD. Banting lecture 2001: dysregulation of fatty acid metabolism in the etiology of type 2 diabetes. Diabetes (2002); 51:7–18. / Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF, Haqq AM, Shah SH, Arlotto M, Slentz CA, Rochon J, Gallup D, Ilkayeva O, Wenner BR, Yancy WS Jr, Eisenson H, Musante G, Surwit RS, Millington DS, Butler MD, Svetkey LP. A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance. Cell Metab. 2009 Apr;9(4):311-26. / Newgard CB. Interplay between lipids and branched-chain amino acids in development of insulin resistance. Cell Metab. 2012 May 2;15(5):606-14. / Randle PJ. Regulatory interactions between lipids and carbohydrates: the glucose fatty acid cycle after 35 years. Diabetes Metab. Rev (1998); 14: 263–283. / Sowers JR. Obesity as a cardiovascular risk factor. Am J Med (2003); 115 (Suppl 8A), 37S–41S. / Svetkey LP, Stevens, VJ, Brantley PJ, Appel LJ, Hollis JF, Loria CM, Vollmer WM, Gullion CM, Funk K, Smith P. Weight Loss Maintenance Collaborative Research Group. Comparison of strategies for sustaining weight loss: the weight loss maintenance randomized controlled trial. JAMA (2008); 299: 1139–1148. / Wang TJ, Larson MG, Vasan RS, Cheng S, Rhee EP, McCabe E, Lewis GD, Fox CS, Jacques PF, Fernandez C, et al. Metabolite profiles and the risk of developing diabetes. Nat Med (2011); 17: 448–453. / Woo SL, Yang J, Hsu M, Yang A, Zhang L, Lee RP, Gilbuena I, Thames G, Huang J, Rasmussen A, Carpenter CL, Henning SM, Heber D, Wang Y, Li Z. Effects of branched-chain amino acids on glucose metabolism in obese, prediabetic men and women: a randomized, crossover study. Am J Clin Nutr. 2019 Apr 21.
Fonte: Vitaforscience


