Uma das classes de suplementos que mais cresce em termos de consumo e inovação são os populares “pré-treino” ou “pre-workouts”. Dentre os objetivos mais comuns para justificar o consumo estão: melhora de cognição (foco, estado de alerta, raciocínio, etc.), emagrecimento/perda de gordura corporal (o tão chamado efeito termogênico) e desempenho esportivo (força, tolerância ao esforço, etc.). Neste contexto, observa-se uma confusão de valores entre o que é de fato um efeito ergogênico (performance) e estético (composição corporal). Embora possa haver relação entre composição corporal e performance, o mais correto seríamos separar o que de fato é um suplemento com composição e finalidade de aumento de capacidade física e cognitiva (pré-treino), e o que é um suplemento termogênico, voltado primariamente para mudança de composição corporal. Além disso, suplementos pré-treino e termogênicos usualmente são blends (misturas) heterogêneos, abrangendo desde estimulantes (por exemplo, a cafeína) até aminoácidos e compostos nitrogenados (BCAAs, creatina, nitrato, etc.). Tal heterogeneidade dificulta a interpretação dos resultados obtidos nos estudos acerca do potencial ergogênico de um determinado ingrediente ou da combinação de ingredientes como um todo. Portanto, é mais factível entendermos os resultados apresentados abaixo como produto final da mistura de componentes.
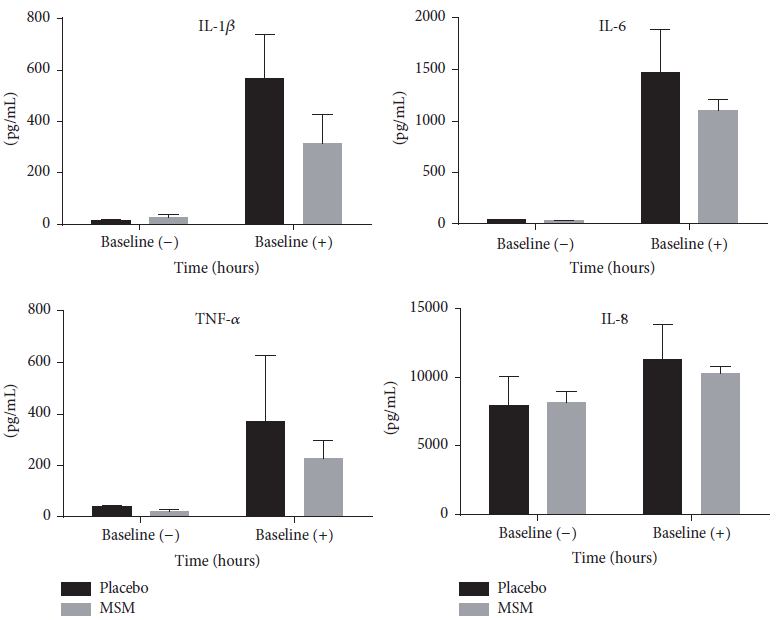
Podemos dividir as evidências científicas em estudos agudos (1 dose) e crônico (dias ou semanas de suplementação). No tocante aos estudos agudos, Wylie et al. (2013) avaliaram os efeitos de 3 doses de nitrato sobre o desempenho esportivo em ergômetro. Os autores testaram as dosagens de 70, 140 e 280 ml de suco de beterraba (18, 73 e 290 mg de nitrato, respectivamente) 2 horas e meia antes da sessão de exercício realizada até a exaustão. O consumo feito 2 horas e meia antes do exercício tem seu racional fundamentado no fato que este é o tempo necessário para que os metabólitos do óxido nítrico (nitrato e nitrito) atinjam o pico plasmático. Os resultados demonstraram aumento do tempo de exaustão frente ao consumo de 73 mg de nitrato no pré-treino. Em ensaio randomizado, duplo cego, cross-over e controlado por placebo.
Jagim et al. (2015), também de forma randomizada, duplo cega, cross-over e controlada por placebo utilizaram um blend a base de carboidrato, creatina, beta-alanina, betaína e taurina (dentre outros ingredientes) 30 minutos antes de uma sessão de exercício anaeróbio (sprint) em jogadores de futebol americano. Foi observado aumento significativo da potência média gerada dentro da sessão (1397 ± 257 vs 1468 ± 304 W), indicando a eficácia ergogênica da suplementação. O mesmo grupo avaliou posteriormente o impacto desta mistura, na mesma população, sobre o sistema nervoso central e volume de treinamento. Os autores observaram que o tempo de reação dos jogadores de futebol americano diminuiu significativamente após a suplementação. Além disso, o número de repetições executadas no leg press a 75% da força máxima aumentou de modo significativo no grupo suplementado. Juntos, esses dois estudos mostram que a partir de uma combinação de ingredientes, é possível obter efeitos ergogênicos centrais e periféricos otimizando capacidades físicas que são pilares dentro da modalidade. Em estudos agudos, composição corporal não é tratada como desfecho em função da limitação de tempo. Porém, há estudos crônicos que consideram, além do efeito ergogênico, o impacto da suplementação sobre medidas de composição.
O’Bryan et al. (2019) avaliaram recentemente, de modo meta-analítico e sistemático, 35 ensaios randomizados que utilizaram suplementos com múltiplos ingredientes por pelo menos 6 semanas em associação ao treinamento de força. A intenção dos autores foi avaliar os ganhos em termos de massa e força muscular. A análise de “qualidade de evidência” demonstrou que os resultados dos estudos não foram influenciados por falhas metodológicas. Como conclusão, o consumo crônico de suplementos com múltiplos ingredientes, em associação ao treinamento de força, promove aumento de massa livre de gordura, força muscular e pode auxiliar na redução da perda de quantidade e qualidade muscular em idosos.
Os estudos apresentados servem de embasamento acerca de eficácia e segurança da suplementação e direcionamento para nossas condutas. Como conclusão geral, suplementos pré-treino não são necessariamente termogênicos. Suplementos pré-treino são destinados a aumento de capacidades físicas, principalmente o aumento do volume de treinamento. Portanto, é fundamental que a suplementação seja aplicada naqueles que realizam suas sessões de treinamento com consciência corporal e já possuem certo grau de maturidade muscular e experiência dentro da modalidade esportiva que pratica, uma vez que o efeito do suplemento depende do aumento de volume de treino. Por fim, embora possam ser híbridos, suplementos pré-treino podem não ter ação termogênica, o que não anula sua eficácia e aplicabilidade.
Referências Bibliográficas:
Jagim AR, Wright GA, Schultz K, St Antoine C, Jones MT, Oliver JM. Effect of acute ingestion of a multi-ingredient pre-workout supplement on lower body power and anaerobic sprint performance. J Int Soc Sports Nutr 2015, 12 (Suppl 1): p49. / Jagim AR, Jones MT, Wright GA, St Antoine C, Kovacs A, Oliver JM. The acute effects of multi-ingredient pre-workout ingestion on strength performance, lower body power, and anaerobic capacity. J Int Soc Sports Nutr. 2016 Mar 8;13:11. / O’Bryan KR, Doering TM, Morton RW, Coffey VG, Phillips SM, Cox GR. Do multi-ingredient protein supplements augment resistance training-induced gains in skeletal muscle mass and strength? A systematic review and meta-analysis of 35 trials. Br J Sports Med. 2019 Mar 1. / Wylie LJ, Kelly J, Bailey SJ, Blackwell JR, Skiba PF, Winyard PG, Jeukendrup AE, Vanhatalo A, Jones AM. Beetroot juice and exercise: pharmacodynamic and dose-response relationships. J Appl Physiol (1985). 2013 Aug 1;115(3):325-36.
Fonte: Vitaforscience